【编者按】自2024年国办53号文件出台一年来,各地加快政策落地,药监系统深化改革、强化全链条监管、优化服务,筑牢安全底线,激活创新生态,引领产业向高端突破,全国医药行业正形成勃发进取的新态势。为此,新华网联合国家药监局新闻中心推出“深化药械改革 各地在行动”系列报道,深入解读行业变革,记录这场以创新驱动的高质量发展历程。
新华网石家庄1月28日电(张悦)如何让已上市药品的技术升级跑出“加速度”?又如何将医生的“金点子”快速转化为患者用得上、用得起的创新医疗器械?近年来,河北省药品监督管理局全面贯彻落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》,以优化药品补充申请审评审批试点和“春雨行动”为抓手,推动监管资源向前沿技术、创新产品精准倾斜,通过“点对点、面对面”的一站式服务,全力打通医药创新成果转化的“最后一公里”,为全省生物医药产业高质量发展注入新动能。
审评提速:按下药品升级的“快进键”
在药品领域,一场以效率为核心的变革正在进行。2024年11月,经国家药监局批准,河北省获批开展优化药品补充申请审评审批程序改革试点,推动药品上市后重大变更审评进入“快车道”,促进了省内医药产业高质量发展。
改革的核心,在于通过省级前置服务与国家药监局药品审评中心审评程序的高效衔接,将原本周期长的线性流程,重构为多环节并联推进、无缝衔接的加速流程。石药集团、石家庄四药集团有关负责人对此感受深刻:“最直观的变化是周期大幅缩短,整体时间明显压缩。”
为确保政策红利精准释放,河北省药监局加大政策宣贯解读力度,构建了“线上+线下”全方位宣贯体系,并设立专线提供“一对一”精准指导。试点以来,共接收13家企业24个品种35个品规前置服务申请,办结27个申请,共计发出前置检验22次、前置核查12次、完成立卷报告12个,目前已有3家企业的6个补充申请获得国家药监局批准。
石药集团第一制造中心副总裁赵振坤介绍,公司特殊制剂变更处方工艺、扩大批量,注射剂变更内包材种类、调整注册标准等情况都需要进行重大变更申请。通过省级药品监管部门对企业的前置指导服务,受理与审评时限得到大幅压缩。

石药集团欧意药业有限公司质量部仪器组正在设置流速、波长、温度等色谱条件。新华网发(受访者供图)
赵振坤表示,此前申请采用传统“串联式”流程,政策试点后升级为“并联式”加速流程,国家药监局药品审评中心(CDE)技术审评时限也从200个工作日压缩至60个工作日。部分工作如核查、检验、稳定性考察等,企业可在省局前置服务审查期间完成,而河北省药监局就像是企业与国家药监局沟通的桥梁,针对申请申报中的重点难点问题,企业可随时与省级审评专家开展多轮沟通研讨,全程获得省药监局有关部门的“一对一”专业指导,帮助企业高效完成变更研究、抽样、检验、注册核查及CDE申报工作。
赵振坤举例道,依托相关政策,石药集团艾司奥美拉唑镁肠溶胶囊扩批量变更项目补充申请申报流程上报到国家药监局后一次性通过,自申报至获批仅用时30个工作日。另外,注射用奥美拉唑钠变更胶塞种类、丁苯酞氯化钠注射液调整注册标准等前置服务申请,均已通过省级立卷审查并上报国家药监局。这一举措有助于企业迭代技术、提质增效,企业能更快地将质量更好的产品推向市场。
石家庄四药集团药物研究院副院长夏国龙说,“通常情况下,即使在不发补的情况下,企业从申报到获批通常需要一年以上,若遇发补则可能延长至近两年。而目前整体时间压缩明显,现在一般半年左右即可完成从申报到获批的全过程,这对企业来说是非常积极的转变。”
石家庄四药集团研发人员正在研发创新药物。新华网发(受访者供图)
夏国龙表示,在审评实际过程中,企业完成相关研究验证后,无需等待稳定性考察全部结束,即可向省局提交申报。省局受理后,会同步启动注册检验和现场核查。与此同时,企业继续进行稳定性考察,一般在三个月稳定性考察期内,审评、检验和核查工作即可同步完成,之后汇总材料申报至国家药监局。国家药监局会在三个月内完成审评审批,企业即可获得批件。
政策试点实施以来,石家庄四药已成功取得包括硫酸镁注射液在内的4个产品批件,另有3个品种正在审评中。“这一流程极大节约了时间成本,也及时响应了我们快速推进变更实施的迫切需求。”
对于企业应当如何借助政策利好进一步发展的问题,夏国龙表示,企业可以从多方面入手。首先,在产品申报前提前与省局沟通变更意向,明确变更路径与可行性;其次,严格遵循相关指导原则,扎实完成各项研究工作,确保数据真实完整;同时,在研究过程中如遇到不确定的问题,应及时与审评部门沟通,避免研究方向出现偏差;最后,企业作为药品上市许可持有人,必须切实履行主体责任,全面把控产品质量,确保每一环节符合法规要求。“政策的优化为我们创造了条件,但最终落地仍需企业科学、严谨地推进。”
赵振坤也认为,药品补充申请与药品注册申请同样重要,有的变更也能给企业发展带来关键影响。利用好政策首先还是要了解政策,企业要积极参与省级政策法规及技术培训,提升专业能力,了解最新最前沿的审评审批政策,申报前主动对接省级审评中心,精准判定变更类别与研究要点,把握55个工作日窗口期,同步完成数据采集与资料提交。
河北省药监局药品注册管理处处长刘颖介绍,下一步河北将重点从三方面发力,确保改革试点取得更好效果:一是坚持标准统一、质量为先,确保审评把关科学严谨;二是强化能力建设与人才储备,为承接更深层次改革任务筑牢基础;三是持续深化对企业指导培训,以更优的审评效能助推全省医药产业创新升级。
“春雨”润泽:疏通成果转化的“高速路”
一款创新型医疗器械从临床创意到产品上市,往往面临需求对接难、转化周期长、资金压力大等多重挑战。“春雨行动”以来,河北省药监局积极促进临床成果转化,搭建河北省医疗器械创新服务平台,覆盖项目“创意挖掘-靠前帮扶-精准对接-细心培育-助推上市”的全链条线上服务生态。通过强宣传、深挖掘,大幅调动起了医疗机构临床成果转化的积极性。
对于临床医生而言,“春雨行动”则提供了一个高效的“产业化接口”。河北医科大学第一医院技术转移中心主任尚方剑介绍,在成果转化的关键“小试”环节,高昂的开模费用常令医生们望而却步。河北省药监局通过“春雨行动”为河北医大一院的很多医生搭建了非常好的平台,与企业共同进行发明专利的转化。“现在通过平台,我们能‘点对点’快速找到具备成熟设备和经验的企业合作,大大缓解了资金压力。”尚方剑的一个发明专利正通过该平台与企业进行联合研发与迭代升级,使其更符合临床实际。
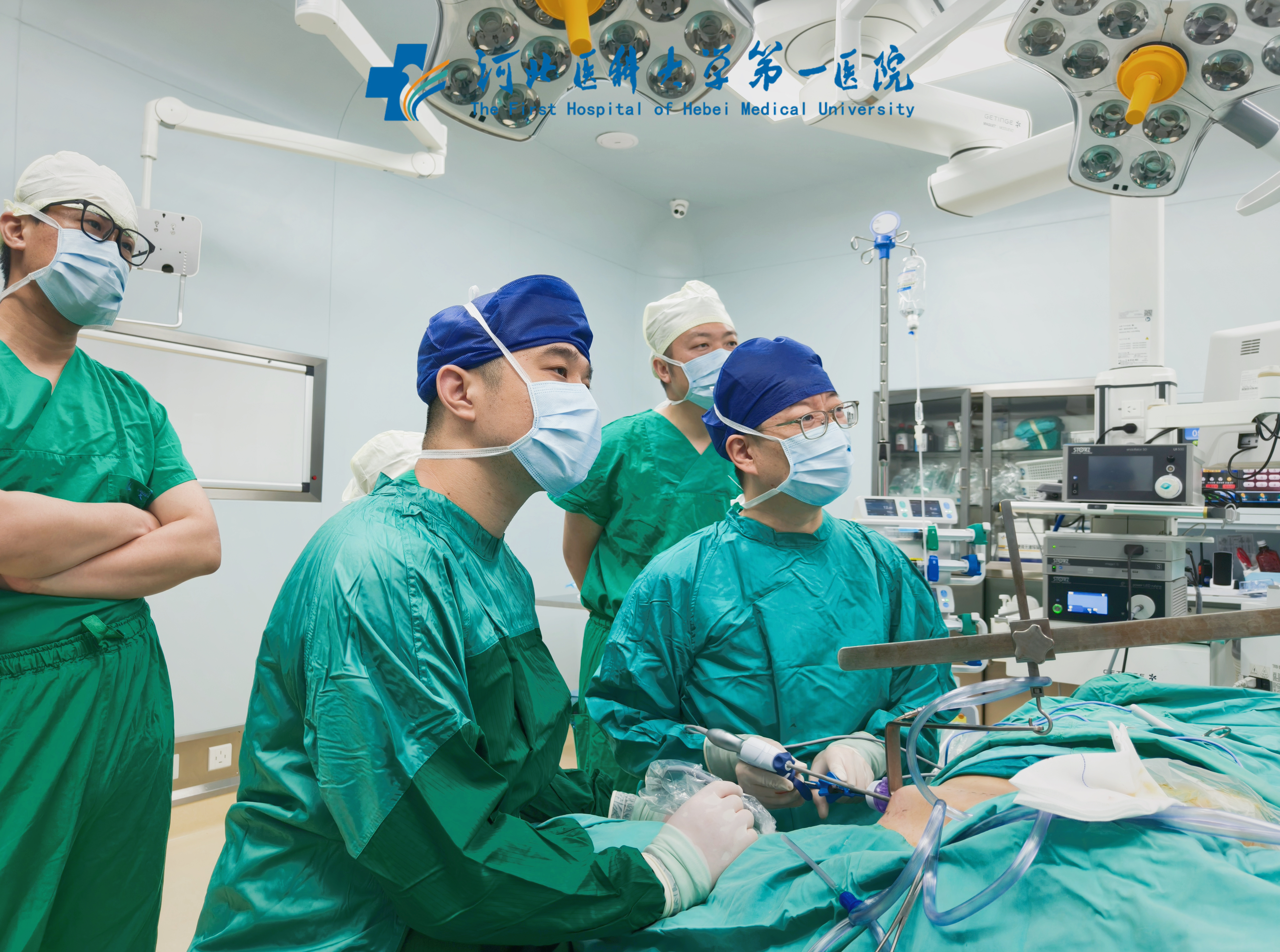
河北医科大学第一医院乳腺甲状腺诊疗中心主任刘擘团队正在为甲状腺癌患者行经腋窝甲状腺腔镜微创手术。新华网发(受访者供图)
河北康誉医疗器械有限公司营销总监刘晶莹表示,医疗器械从临床创意到产品上市的转化,长期面临着临床需求与生产企业脱节、缺乏高效对接平台的核心痛点。企业熟悉生产工艺与产业需求,但对临床一线的真实痛点缺乏精准洞察;而医院了解患者需求与如何破解手术难题,却难以将临床经验转化为可落地的产品方案。此外,也缺乏一个高效、透明的平台进行需求对接、资源匹配和全流程协作,导致转化效率低下,很多优秀的临床想法难以走出实验室。

河北康誉医疗器械有限公司研发人员对球囊产品的关键工序进行探讨交流。新华网发(受访者供图)
刘晶莹表示,“春雨行动”打通了医工融合的通道,使企业能够更早地接触到最真实的、一线的临床需求,从源头确保了研发方向的正确性。同时,对于入选的优质项目,河北省药监局还提供“提前介入、一企一策、全程指导、研审联动”的培育帮扶。这意味着在研发的关键节点,企业能够获得来自审评审批部门的前置技术指导,极大提高了研发效率和成功率。
据了解,试点以来河北省药监局共筛选出52个临床价值明确、转化前景良好的优质项目纳入储备库。通过构建线上线下相结合的精准对接渠道,成功推动23个具有明确临床价值的项目与15家具备研发能力的企业实现“联姻”,其中9个项目已正式签约。
尚方剑表示,相信在“春雨行动”搭建起的医工对接“高速路”上,临床一线的“痛点”能更顺畅地转化为创新解决方案,未来必将有更多源于中国临床实践、惠及国内外患者的医疗器械走向市场。
河北省药监局医疗器械注册管理处处长马俪表示,下一步河北省药监局将常态化开展“春雨行动”,既要拓展宣贯广度,推动政策宣贯向市级医院、专科医院延伸,确保政策红利惠及更广泛创新主体;又要加大挖掘深度,主动深入医院重点科室,及时掌握临床好创新好思路,确保项目早发现、早培育;更要加大服务力度,及时提供“一对一”辅导,推动优质成果早日上市应用。
政策“筑基”:打造产业创新的“新生态”
从药品审评环节“一企一策”的精准服务,到医疗器械成果转化“春雨润泽”的主动行动,河北省药监局的系列举措,彰显了药品监管部门在坚守安全底线前提下,深化监管改革、赋能产业发展的生动实践。
在此基础上,河北省药监局会同省发改委、省工信厅等九部门,共同研究制定了《关于支持创新药械高质量发展若干措施》,已于2025年12月26日正式印发实施。
河北省药监局党组书记、局长王峰山指出,《若干措施》是激发医药创新活力、推动产业升级、壮大产业优势的重要举措,核心目标是“打通‘研发—审评—生产—使用—产业布局’全链条堵点”,引导企业向前沿研发、智能制造和品牌创造等高价值环节转型升级,努力将河北打造为国内领先的医药创新高地。
《若干措施》以全链条支持创新药械高质量发展为主线,共包括五个部分、十八条具体措施。其中,将药品补充申请审评时限压缩至60个工作日的明确目标,正是对“审评提速”改革的成果固化与全面深化;而关于强化医工融合、建设共享平台、破除临床使用瓶颈等条款,则为“春雨行动”的持续拓展注入了制度动能与长久保障。《若干措施》不仅回应了当前企业的迫切需求,更前瞻性地布局了产业创新的基础要素,致力于打造一个“政、产、学、研、医、用”协同共生的创新生态。
“政策的生命力在于执行。”王峰山强调。河北将建立清单管理、跟踪问效等机制,确保18条举措转化为企业可知、可感、可及的发展实效。这意味着,先行企业已体验到的“快进键”与“高速路”,将逐步转化为惠及全省创新主体的普惠性环境与确定性预期。
从疏通药品变更审评“卡点”,到破解医疗器械临床转化“堵点”,再到夯实创新药械高质量发展的“产业新生态”,河北省正以坚实的监管改革步伐,推动监管与服务深度融合。随着政策红利的加速释放、产业生态的持续优化,将为河北“医药强省”的建设注入强劲动能、筑牢坚实根基。